2022年6月29日,智核生物宣布,其自主研发的68Ga标记PD-L1的放射性显影剂药物(SNA002),已获得中国国家药品监督管理局药品审评中心(CDE)的新药临床试验(IND)的临床试验默认许可。SNA002是一款以单域抗体为前体的,偶联放射性PD-L1表达的PET显影药物,拟用于评估实体瘤患者原发和/或转移病灶PD-L1表达水平。
此前,该药物已于今年4月获得美国食品药品监督管理局(FDA)IND批准,这意味着SNA002成为首个获得中美IND双批准的放射性核素显影药物。
智核生物创始人须涛博士表示:此次我们SNA002的IND获得CDE和FDA双批准,证明了我们智核的研发实力,也肯定了我们早期的战略布局。因为中美两国的要求和规则不完全相同,在研发及申报中需同时满足两国的法规要求。我们在立项之初就立足于产品特点及公司实际,制定了清晰的路径图,才有了今天的结果。当然,接下来我们必须戒骄戒躁,稳扎稳打,合理合规的完成I到III期临床试验,真正成为首个中美上市的SRC药物。
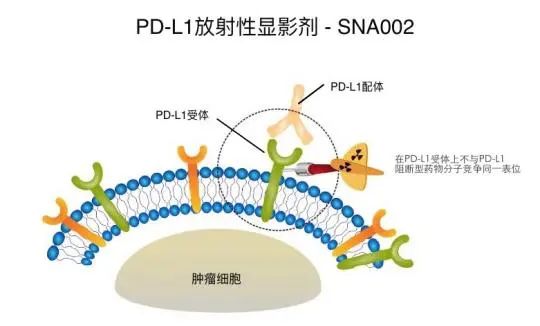
单域抗体同位素偶联药物(Single-domain antibody Radionuclide Conjugates),简称SRC药物,为智核生物自主研发的以单域抗体为前体的放射性核素偶联药物,包括显影诊断药物和治疗药物,SNA002即为其中的显影诊断药物。它是68Ga标记PD-L1的放射性显影剂,注射1-2小时后即可通过PET-CT的方式进行显影,实时、动态显示全身各脏器PD-L1的表达水平,包括肿瘤内部和微小转移灶的异质表达,可实现:
● 精准筛选出对PD-1治疗有效的人群,指导肿瘤患者精准用药,符合伦理、提升患者生活品质、节约患者医疗费用和国家医保资金;
● 打破了有创取样进行免疫组化的传统检测方式,减轻患者痛苦的同时,能够根据疾病发展情况随时进行显影检查。
如今PD-(L)1单抗已经成为全球最成熟的产品,据Frost & Sullivan数据显示,到2023年,全球PD-(L)1抑制剂市场将达639亿美元。而在中国,预计2023年市场规模将达664亿元人民币。PD-L1检测在免疫检查点抑制剂疗效预测的可及性和循证医学证据等方面发挥着非常重要的作用。基于此,PD-L1 检测已经写进了肺癌 NCCN 指南和 CSCO 指南,但由于PD-L1的表达具有时空异质性,传统的免疫组化检测方式如单个部位及单次取样、局部取样等缺点不能准确反映全身 PD-L1 表达情况,使用SNA002进行PET-CT显影可以规避以上缺陷。
关于智核生物
智核生物成立于2015年,是一家以“用最具创新性的核医学诊疗产品,给患者带来希望”为使命的核医药公司,致力于为全球患者提供创新性的放射性核素诊疗药物,产品覆盖甲状腺癌、肿瘤放射性核素诊断药物与治疗药物等领域。公司成立至今已获得4轮累计超过2亿元的风险投资。
智核生物创建了具有自主知识产权的基于单域抗体的放射性药物发现、研发、生产技术平台。公司前瞻性的布局了一系列专业化、高质量的放射性药物研发管线,涵盖10多个创新核素诊断和治疗产品,首个针对甲状腺癌放射性碘治疗的重组人促甲状腺激素(SNA001)已递交新药上市申请,未来将填补中国大陆用药空白;多个创新的针对肿瘤的放射性显影药物已经逐步进入临床,其中首个自主研发的放射性核素标记PD-L1的显影剂(SNA002)已获得FDA和CDE临床试验申请批准。